EL ESTADO GASEOSO
El estado gaseoso es un estado disperso de la materia, es decir , que las moléculas del gas están separadas unas de otras por distancias mucho mayores del tamaño del diámetro real de las moléculas. Resuelta entonces, que el volumen ocupado por el gas (V) depende de la presión (P) , la temperatura (T) y de la cantidad o numero de moles ( n).
Las propiedades de la materia en estado gaseoso son:
1. Se adaptan a la forma y el volumen del recipiente que los contiene. Un gas, al cambiar de recipiente, se expande o se comprime, de manera que ocupa todo el volumen y toma la forma de su nuevo recipiente.
2. Se dejan comprimir fácilmente. Al existir espacios intermoleculares, las moléculas se pueden acercar unas a otras reduciendo su volumen, cuando aplicamos una presión.
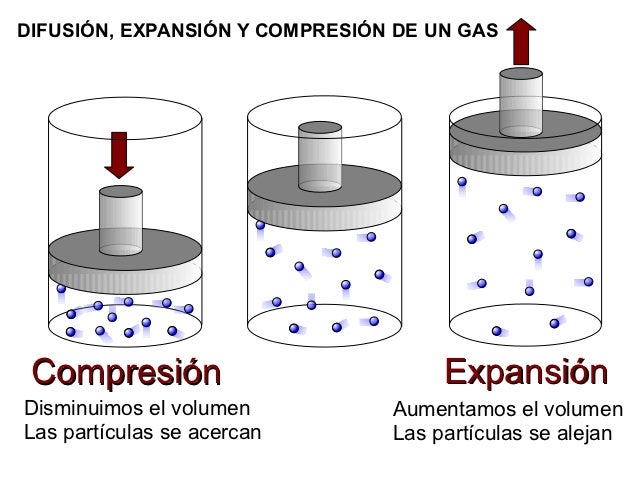

3. Se difunden fácilmente. Al no existir fuerza de atracción intermolecular entre sus partículas, los gases se esparcen en forma espontánea.

4. Se dilatan, la energía cinética promedio de sus moléculas es directamente proporcional a la temperatura aplicada.
Variables que afectan el comportamiento de los gases:
1. PRESIÓN
Es la fuerza ejercida por unidad de área. En los gases esta fuerza actúa en forma uniforme sobre todas las partes del recipiente.
La presión atmosférica es la fuerza ejercida por la atmósfera sobre los cuerpos que están en la superficie terrestre. Se origina del peso del aire que la forma. Mientras más alto se halle un cuerpo menos aire hay por encima de él, por consiguiente la presión sobre él será menor.
2. TEMPERATURA
Es una medida de la intensidad del calor, y el calor a su vez es una forma de energía que podemos medir en unidades de calorías. Cuando un cuerpo caliente se coloca en contacto con uno frío, el calor fluye del cuerpo caliente al cuerpo frío.
La temperatura de un gas es proporcional a la energía cinética media de las moléculas del gas. A mayor energía cinética mayor temperatura y viceversa.
La temperatura de los gases se expresa en grados kelvin.
3. CANTIDAD
La cantidad de un gas se puede medir en unidades de masa, usualmente en gramos. De acuerdo con el sistema de unidades SI, la cantidad también se expresa mediante el número de moles de sustancia, esta puede calcularse dividiendo el peso del gas por su peso molecular.
4. VOLUMEN
Es el espacio ocupado por un cuerpo.
5. DENSIDAD
Es la relación que se establece entre el peso molecular en gramos de un gas y su volumen molar en litros.
A continuación puedes observar el siguiente video para que comprendas mejor las propiedades de los gases.
Leyes de los gases ideales
Gas ideal
Es el comportamiento que presentan aquellos gases cuyas moléculas no interactúan entre sí y se mueven aleatoriamente. En condiciones normales y en condiciones estándar, la mayoría de los gases presentan comportamientos de gases ideales.
Ley de Boyle
Si se reduce la presión sobre un globo, éste se expande, es decir aumenta su volumen, siendo esta la razón por la cual los globos meteorológicos se expanden a medida que se elevan en la atmósfera. Por otro lado, cuando un volumen de un gas se comprime, la presión del gas aumenta. El químico Robert Boyle (1627 - 1697) fue el primero en investigar la relación entre la presión de un gas y su volumen.
La ley de Boyle, que resumen estas observaciones, establece que:
El volumen de una determinada cantidad de gas, que se mantiene a Temperatura constante, es inversamente proporcional a la Presión que ejerce, lo que se resumen en la siguiente expresión:
P. V = Constante o P = 1 / V
y se puede representar gráficamente como:

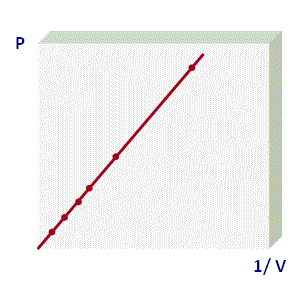
La forma que más utilizamos para representar la ley de Boyle corresponde a la primera gráfica, donde se forma una hipérbola equilatera y podemos utilizar la siguiente expresión para determinar los valores de dos puntos de la gráfica:
P1 . V1 = P2 . V2
Este tipo de gráficos se determina Isotermas, por lo que a los procesos que cumplen con la ley de Boyle se les llama isotérmicas. Recuerda que para que se cumpla la Ley de Boyle es importante y necesario que tanto el número de moles del gas como la Temperatura permanezcan constantes.
Visita el Siguiente Link para que puedas observar una simulación de esta ley y mejorar tu nivel de comprensión:
Ley de Charles
Cuando se calienta el aire contenido en los globos aerostáticos estos se elevan, porque el gas se expande. El aire caliente que está dentro del globo es menos denso que el aire que está en el entorno, a la misma presión, la diferencia de densidad hace que el globo ascienda. Similarmente, si un globo se enfría, este se encoge, reduce su volumen. La relación entre la Temperatura y el Volumen fue enunciada por el cuentífico frances J. Charles (1746 - 1823), utilizando muchos de los experimentos realizados por J. Gay Lussas (1778 - 1823).
La ley de Charles se resume en:
El volumen de una determinada cantidad de gas que se mantiene a presión constante, es directamente proporcional a su Temperatura absoluta, que se expresa como:
V = Constante
T
y gráficamente se representa como:
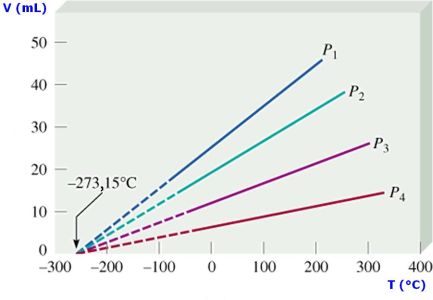
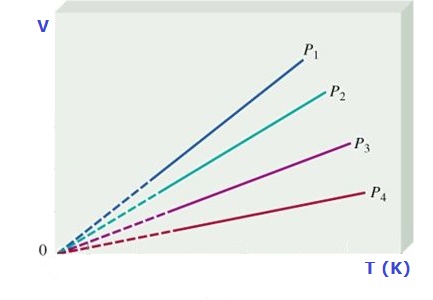
Debemos tener presente que la temperatura se debe expresar en grados Kelvin y para determinar los valores entre dos puntos cuales quiera de la recta podemos usar:
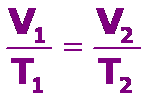
Los procesos que se realizan a presión constate se denominan procesos isobáricos.
Visita el Siguiente Link para que puedas observar una simulación de esta ley y mejorar tu nivel de comprensión:
Ley de Gay Lussac
La ley de Gay Lussac se expresa de la siguiente manera:
La presión de una determinada cantidad de un gas que se mantiene a volumen constante, es directamente proporcional a su temperatura absoluta.
Esta ley que se expresa como:
P = Constante
T
Los procesos que se producen a volumen constante se denominan procesos Isocóricos. Para determinar los valores entre dos estados podemos usar:
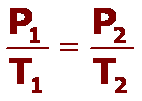
Visita el Siguiente Link para que puedas observar una simulación de esta ley y mejorar tu nivel de comprensión:
Ley general del gas ideal
Las leyes que hemos estudiado se cumplen cuando se trabaja a bajas presiones y temperaturas moderadas. Tenemos que:
Cuando estas leyes se combinan en una sola ecuación, se obtiene la denominada ecuación general de los gases ideales:
P V = n R T
donde la nueva constante de proporcionalidad se denomina R, constante universal de los gases ideales, que tiene el mismo valor para todas las sustancias gaseosas. El valor numérico de R dependerá de las unidades en las que se trabajen las otras propiedades, P, V, T y n. En consecuencia, debemos tener cuidado al elegir el valor de R que corresponda a los cálculos que estemos realizando, así tenemos:
| Valor de R | Unidades |
|---|---|
| 0,082 | 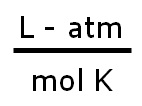 |
| 8,314 | 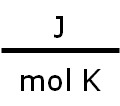 |
| 1,987 |  |
Los gases tienen un comportamiento ideal cuando sus moléculas se encuentran a bajas presiones y temperaturas moderadas, en las cuales se mueven lo suficientemente alejadas unas de otras, de modo que se puede considerar que sus moléculas no interactúan entre sí (no hay acción de las fuerzas intermoleculares).
Como hemos observado, son cuatro (4) las propiedades que definen el estado o las condiciones en las que se encuentra una sustancia en estado gaseoso: la cantidad de sustancia o número de moles, n; la presión que ejercen sus moléculas, P; la temperatura a la que se encuentra, T y el volumen que ocupa, V. Estas propiedades pueden variar todas simultáneamente o se pueden mantener constantes una o dos de ellas a fin de cambiar las otras.
Para profundizar más es estos importantes conceptos observa los siguientes videos.


buenísima información muchas gracias
ResponderBorrar